Biologie-Schule.de
Das Nachschlagewerk für Biologie

Elektronenkonfiguration? Definition und Tabelle ...
 Die Elektronenkonfiguration gibt die Anordnung bzw. Verteilung
der Elektronen in einem Atom an.
Die Elektronenkonfiguration gibt die Anordnung bzw. Verteilung
der Elektronen in einem Atom an.
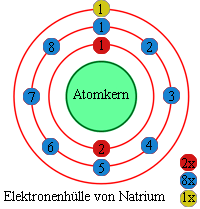
In der Abbildung rechts ist schematisch die Elektronenhülle von Natrium
dargestellt. Für Natrium ergibt sich dabei folgende Elektronenkonfiguration: [Ne] 3s1
Diese Schreibweise ist bereits verkürzt. Das Edelgas mit der nächstkleineren Ordnungszahl
(Natrium mit der Ordnungszahl 11; demnach Neon mit der Ordnungszahl 10) wird der
Elektronenkonfiguration vorangestellt. Damit wird ausgedrückt, dass bei Natrium die selben Schalen mit der gleichen Zahl an
Elektronen besetzt sind, wie es auch bei Neon der Fall ist. Zusätzlich befindet sich beim Natrium-Atom in der dritten Schale ein weiteres Elektron.
Das 's' steht hier allerdings nicht für 'Schale', sondern für das Orbital, in dem sich das Elektron aufhält. Neben dem s-Orbital sind für
schulische Zwecke noch das p-Orbital, d-Orbital und f-Orbital relevant (siehe auch: Block des Periodensystems).
Die Besetzung der Orbitale durch Elektronen erfolgt in dieser Reihenfolge:
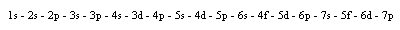
Liste / Tabelle der Elektronenkonfigurationen:
| Ordnungszahl | Chem. Element | Elektronenkonfiguration |
|---|---|---|
| 1 | Wasserstoff | 1s1 |
| 2 | Helium | 1s2 |
| 3 | Lithium | [He] 2s1 |
| 4 | Beryllium | [He] 2s2 |
| 5 | Bor | [He] 2s2 2p1 |
| 6 | Kohlenstoff | [He] 2s2 2p2 |
| 7 | Stickstoff | [He] 2s2 2p3 |
| 8 | Sauerstoff | [He] 2s2 2p4 |
| 9 | Fluor | [He] 2s2 2p5 |
| 10 | Neon | [He] 2s2 2p6 |
| 11 | Natrium | [Ne] 3s1 |
| 12 | Magnesium | [Ne] 3s2 |
| 13 | Aluminium | [Ne] 3s2 3p1 |
| 14 | Silizium | [Ne] 3s2 3p2 |
| 15 | Phosphor | [Ne] 3s2 3p3 |
| 16 | Schwefel | [Ne] 3s2 3p4 |
| 17 | Chlor | [Ne] 3s2 3p5 |
| 18 | Argon | [Ne] 3s2 3p6 |
| 19 | Kalium | [Ar] 4s1 |
| 20 | Calcium | [Ar] 4s2 |
| 21 | Scandium | [Ar] 3d1 4s2 |
| 22 | Titan | [Ar] 3d2 4s2 |
| 23 | Vanadium | [Ar] 3d3 4s2 |
| 24 | Chrom | [Ar] 3d5 4s1 |
| 25 | Mangan | [Ar] 3d5 4s2 |
| 26 | Eisen | [Ar] 3d6 4s2 |
| 27 | Cobalt | [Ar] 3d7 4s2 |
| 28 | Nickel | [Ar] 3d8 4s2 |
| 29 | Kupfer | [Ar] 3d10 4s1 |
| 30 | Zink | [Ar] 3d10 4s2 |
| 31 | Gallium | [Ar] 3d10 4s2 4p1 |
| 32 | Germanium | [Ar] 3d10 4s2 4p2 |
| 33 | Arsen | [Ar] 3d10 4s2 4p3 |
| 34 | Selen | [Ar] 3d10 4s2 4p4 |
| 35 | Brom | [Ar] 3d10 4s2 4p5 |
| 36 | Krypton | [Ar] 3d10 4s2 4p6 |
| 37 | Rubidium | [Kr] 5s1 |
| 38 | Strontium | [Kr] 5s2 |
| 39 | Yttrium | [Kr] 4d1 5s2 |
| 40 | Zirconium | [Kr] 4d2 5s2 |
| 41 | Niob | [Kr] 4d4 5s1 |
| 42 | Molybdän | [Kr] 4d5 5s1 |
| 43 | Technetium | [Kr] 4d6 5s1 |
| 44 | Ruthenium | [Kr] 4d7 5s1 |
| 45 | Rhodium | [Kr] 4d8 5s1 |
| 46 | Palladium | [Kr] 4d10 |
| 47 | Silber | [Kr] 4d10 5s1 |
| 48 | Cadmium | [Kr] 4d10 5s2 |
| 49 | Indium | [Kr] 4d10 5s2 5p1 |
| 50 | Zinn | [Kr] 4d10 5s2 5p2 |
| 51 | Antimon | [Kr] 4d10 5s2 5p3 |
| 52 | Tellur | [Kr] 4d10 5s2 5p4 |
| 53 | Iod | [Kr] 4d10 5s2 5p5 |
| 54 | Xenon | [Kr] 4d10 5s2 5p6 |
| 55 | Caesium | [Xe] 6s1 |
| 56 | Barium | [Xe] 6s2 |
| 57 | Lanthan | [Xe] 5d1 6s2 |
| 58 | Cer | [Xe] 4f2 6s2 |
| 59 | Praseodym | [Xe] 4f3 6s2 |
| 60 | Neodym | [Xe] 4f4 6s2 |
| 61 | Promethium | [Xe] 4f5 6s2 |
| 62 | Samarium | [Xe] 4f6 6s2 |
| 63 | Europium | [Xe] 4f7 6s2 |
| 64 | Gadolinium | [Xe] 4f7 5d1 6s2 |
| 65 | Terbium | [Xe] 4f9 6s2 |
| 66 | Dysprosium | [Xe] 4f10 6s2 |
| 67 | Holmium | [Xe] 4f11 6s2 |
| 68 | Erbium | [Xe] 4f12 6s2 |
| 69 | Thulium | [Xe] 4f13 6s2 |
| 70 | Ytterbium | [Xe] 4f14 6s2 |
| 71 | Lutetium | [Xe] 4f14 5d1 6s2 |
| 72 | Hafnium | [Xe] 4f14 5d2 6s2 |
| 73 | Tantal | [Xe] 4f14 5d3 6s2 |
| 74 | Wolfram | [Xe] 4f14 5d4 6s2 |
| 75 | Rhenium | [Xe] 4f14 5d5 6s2 |
| 76 | Osmium | [Xe] 4f14 5d6 6s2 |
| 77 | Iridium | [Xe] 4f14 5d7 6s2 |
| 78 | Platin | [Xe] 4f14 5d9 6s1 |
| 79 | Gold | [Xe] 4f14 5d10 6s1 |
| 80 | Quecksilber | [Xe] 4f14 5d10 6s2 |
| 81 | Thallium | [Xe] 4f14 5d10 6s2 6p1 |
| 82 | Blei | [Xe] 4f14 5d10 6s2 6p2 |
| 83 | Bismut | [Xe] 4f14 5d10 6s2 6p3 |
| 84 | Polonium | [Xe] 4f14 5d10 6s2 6p4 |
| 85 | Astat | [Xe] 4f14 5d10 6s2 6p5 |
| 86 | Radon | [Xe] 4f14 5d10 6s2 6p6 |
| 87 | Francium | [Rn] 7s1 |
| 88 | Radium | [Rn] 7s2 |
| 89 | Actinium | [Rn] 6d1 7s2 |
| 90 | Thorium | [Rn] 6d2 7s2 |
| 91 | Protactinium | [Rn] 5f2 6d1 7s2 |
| 92 | Uran | [Rn] 5f3 6d1 7s2 |
| 93 | Neptunium | [Rn] 5f4 6d1 7s2 |
| 94 | Plutonium | [Rn] 5f6 7s2 |
| 95 | Americium | [Rn] 5f7 7s2 |
| 96 | Curium | [Rn] 5f7 6d1 7s2 |
| 97 | Berkelium | [Rn] 5f9 7s2 |
| 98 | Californium | [Rn] 5f10 7s2 |
| 99 | Einsteinium | [Rn] 5f11 7s2 |
| 100 | Fermium | [Rn] 5f12 7s2 |
| 101 | Mendelevium | [Rn] 5f13 7s2 |
| 102 | Nobelium | [Rn] 5f14 7s2 |
| 103 | Lawrencium | [Rn] 5f14 6d1 7s2 |
| 104 | Rutherfordium | [Rn] 5f14 6d2 7s2 |
| 105 | Dubnium | [Rn] 5f14 6d3 7s2 |
| 106 | Seaborgium | [Rn] 5f14 6d4 7s2 |
| 107 | Bohrium | [Rn] 5f14 6d5 7s2 |
| 108 | Hassium | [Rn] 5f14 6d6 7s2 |
| 109 | Meitnerium | [Rn] 5f14 6d7 7s2 |
| 110 | Darmstadtium | [Rn] 5f14 6d9 7s1 |
| 111 | Roentgenium | [Rn] 5f14 6d10 7s1 |
| 112 | Copernicium | [Rn] 5f14 6d10 7s2 |
| 113 | Nihonium | [Rn] 5f14 6d10 7s2 7p1 |
| 114 | Flerovium | [Rn] 5f14 6d10 7s2 7p2 |
| 115 | Moscovium | [Rn] 5f14 6d10 7s2 7p3 |
| 116 | Livermorium | [Rn] 5f14 6d10 7s2 7p4 |
| 117 | Tenness | [Rn] 5f14 6d10 7s2 7p5 |
| 118 | Oganesson | [Rn] 5f14 6d10 7s2 7p6 |
Geschichte zur Elektronenkonfiguration und Probleme:
Im Jahr 1919 legte der US-amerikanische Physiker und Chemiker Irving Langmuir mit seiner Veröffentlichung "The Arrangement of Electrons in Atoms and Molecules"
eine wichtige Grundlage zu den Überlegungen zur Elektronenkonfiguration. Einige Jahre später griff Niels Bohr die Idee auf und entwickelte
diese zum Aufbauprinzip weiter (engl. aufbau principle).
Allerdings sind die Elektronenkonfigurationen ab der Ordnungszahl 104 (Rutherfordium) bislang noch nicht bewiesen worden. Trotz der experimentell nachgewiesenen
Elektronenkonfigurationen für den Großteil der übrigen Elemente, verhalten sich insbesondere schwerere Elemente im Periodensystem nicht zuverlässig nach den Regeln des Aufbauprinzips. Problematisch sind die zahlreichen Ausnahmen beim Aufbauprinzip. Dies betrifft die Elemente Chrom, Molybdän, Kupfer, Silber, Gold, Nickel,
Palladium, Platin, Gadolinium, Curium, Lanthan, Actinium, Thorium, Niob, Ruthenium, Rhodium, Cer, Protactinium, Uran und Neptunium. Aufgrunddessen sind die Angaben
in der Tabelle mit Vorsicht zu genießen. Einzelne oder mehrere Angaben könnten nicht der tatsächlich vorkommenden Elektronenkonfiguration entsprechen und sind nach wie vor
Gegenstand der Forschung.
Zusammenfassung
- Die Elektronenkonfiguration gibt die Anzahl und Verteilung der Elektronen in der Elektronenhülle des Atoms an.
Weiterführende Links