Biologie-Schule.de
Das Nachschlagewerk für Biologie

Was ist ein Isotop? Definition und Erklärung anhand eines Beispiels:
Atome mit identischer Kernladungszahl (Protonenzahl), jedoch unterschiedlicher Anzahl
an Neutronen, werden als Isotope bezeichnet.
Exemplarisch zum Verständnis dazu ein Beispiel: Die beiden Uran-Isotope Uran-235 und Uran-238 verfügen über je 92 Protonen in ihrem
Atomkern. Die Zahl der Protonen im Atomkern bestimmt immer, um welches chemische Element es sich bei dem Atom handelt. Im
Periodensystem kann die Zahl der Protonen eines beliebigen Elements leicht an der Ordnungszahl abgelesen werden. Diese
ist mit der Kernladungszahl, also der Anzahl der Protonen, identisch.
235 bzw. 238 gibt die Massenzahl bzw. Nukleonenzahl an. Diese Zahl sagt aus, wieviele Protonen und Neutronen sich insgesamt im
Atomkern befinden. Uran-235 verfügt über 143 Neutronen (Proberechnung: 92 + 143 = 235), Uran-238 über 146 Neutronen (Proberechnung: 92 + 146 = 238).
Das ganze noch einmal zur Übersicht:
Uran-235  92 Protonen + 143 Neutronen = 235 (Massenzahl)
92 Protonen + 143 Neutronen = 235 (Massenzahl)
Uran-238  92 Protonen + 146 Neutronen = 238 (Massenzahl)
92 Protonen + 146 Neutronen = 238 (Massenzahl)
Was anhand dieses Beispiels ersichtlich werden soll: Es handelt sich bei Isotopen aus einer Elementreihe (in diesem Fall Uran) immer um ein einziges Element.
Das Unterscheidungsmerkmal besteht in der unterschiedlichen Neutronenzahl! Wenn man das Isotop also kennt, kann man leicht die entsprechende
Neutronenzahl ausrechnen:
Massenzahl = Ordnungszahl + Neutronenzahl
Natürlich besitzt nicht nur das chemische Element Uran Isotope. Insgesamt sind über 3000
verschiedene Isotope bekannt. Jedes Element verfügt über eine mehr oder minder große Anzahl an Isotopen.
Interessante Fakten zu Isotopen:
Der Begriff Isotop leitet sich vom griechischen 'isos' für 'gleich' und 'topos' für 'Ort' ab. Im Periodensystem
findet keine Unterscheidung zwischen den Isotopen der jeweiligen Elemente statt. Sie stehen deshalb am 'gleichen Ort'
im Periodensystem, also ihrem Stammelement.
Grundsätzlich kann man Isotope auf zwei Ebenen kategorisieren. Das sind einerseits die stabilen vs. instabilen Isotope. Stabile
Isotope weisen grundsätzlich keinen radioaktiven Zerfall auf und bleiben somit in ihrer 'Form' erhalten. Dagegen
zerfallen instabile Isotope, abhängig von den jeweiligen Halbwertszeiten, in andere Isotope bzw. Elemente. Die überwiegende
Anzahl der bekannten Isotope ist instabil, z.T. betragen die Halbwertszeiten nur wenige Sekunden.
Darüber hinaus können Isotope noch nach natürlichen vs. künstlichen Isotopen kategorisiert werden. Letztere sind praktisch
nicht in der Natur beobachtbar, also rein theoretischer Überlegung bzw. von Wissenschaftlern gezielt im Labor herbeigeführt worden.
Die für den Menschen relevanten Isotope (z.B. 12Kohlenstoff) sind fast ausnahmslos nicht radioaktiv und damit
stabil. Andernfalls wäre ein Überleben auch kaum möglich, wenn die winzigen Komponenten unserer Körperzellen unter Freisetzung von radioaktiver Strahlung
in andere Isotope zerfallen.
Isotope des Wasserstoffs:
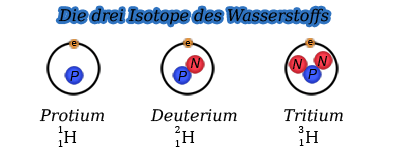
Abschließend noch ein kurzer Blick auf die drei wichtigsten Isotope des Wasserstoffs.
 Protium: 99,9% des weltweiten Wasserstoffs entfallen auf Protium
Protium: 99,9% des weltweiten Wasserstoffs entfallen auf Protium
 Deuterium: auch als "schwerer Wasserstoff" bezeichnet
Deuterium: auch als "schwerer Wasserstoff" bezeichnet
 Tritium: auch als "superschwerer Wasserstoff" bezeichnet, radioaktiv
Tritium: auch als "superschwerer Wasserstoff" bezeichnet, radioaktiv
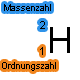 Die Abbildung rechts zeigt die Schreibweise im Falle von Deuterium. Oben links steht die Massenzahl (Anzahl der Protonen + Neutronen), unten
links die Ordnungszahl des Elements, in diesem Fall die 1 für Wasserstoff (H).
Die Abbildung rechts zeigt die Schreibweise im Falle von Deuterium. Oben links steht die Massenzahl (Anzahl der Protonen + Neutronen), unten
links die Ordnungszahl des Elements, in diesem Fall die 1 für Wasserstoff (H).
Zusammenfassung
- Als Isotop bezeichnet man Atome eines chemischen Elements, die sich in ihrer Neutronenzahl unterscheiden.
- Kategorisiert wird zwischen stabilen- und instabilen Isotopen sowie natürlichen- und künstlichen Isotopen.
Weiterführende Links